Mi az elektronkonfiguráció?
Az elektronkonfiguráció az atom (vagy molekula) elektronjainak eloszlása atomi vagy molekuláris pályákon
Mi az orbitális? (Egyszerű definíció)
Az elektron a mag körül bárhol megtalálható. A pálya az elektron legvalószínűbb helye az atom körül
Ha szeretné látni, hogy néz ki egy pálya:
Konfigurációs példa (jelölés)
A neonatom elektronkonfigurációja 1s² 2s² 2p⁶
Orbitális példa
1s² egy sajátos pálya. Ebben a példában:
- "1" az energiaszint
- "s" az orbitális típus
- "2" a benne lévő elektronok száma
Megjegyzés: A "2s²" és a "2p⁶" is pályák
Kagylók és alhéjak
Az elektronkonfigurációkat héjak és alhéjak osztják fel
Mi az elektronhéj? (Egyszerű definíció)
Az elektronhéj az atom külső részének része. Ez a pályák egy csoportja, amelynek értéke megegyezik a kvantumszám értékével
Számokat vagy betűket kapnak "K" -tól "Q" -ig
A neon példában:
- 1s² (1 a kvantumszám és a héj)
- 2s² (2 a kvantumszám és a héj)
Mi az elektron alhéja? (Egyszerű definíció)
Az alhéj az elektronhéjak alosztálya, amelyet elektronpályák választanak el. Az alhéjakat s, p, d és f jelöléssel látjuk el
A neon példában:
- 1s² (s az alhéj)
- 2p⁶ (p az alhéj)
Miért fontos az elektronkonfiguráció?
Biztosan nem hallottál proton vagy neutron konfigurációról, igaz?Ez azért van, mert könnyen megtalálhatók, tudjuk, hol vannak. Nem mondhatja el ugyanezt az elektronokról
Valójában, amikor azt mondjuk, hogy az elektron egy pálya, az azért van, mert nagy a valószínűsége, hogy ott van. Nem azért, mert biztosak vagyunk benne. Ez az "orbitális" definíciója
Tehát az elektronkonfiguráció tanulmányozásának fő okai a következők:
- Az elektronokat nehéz megtalálni
- Az elektronok az oka annak, hogy az atomok és a molekulák kölcsönhatásba lépnek egymással
- Segít megjósolni egy elem tulajdonságait
- Segít meghatározni egy elem valenciáját
Egyéb alkalmazások
Író elektron konfigurációk
Először is meg kell értenünk, hogy az elektronok hogyan választják meg, hol lesznek. Más néven "általános szabályok"
Ezután elmagyarázom az elektronkonfiguráció hagyományos írásának módját, majd elmagyarázom a használható hack -et
1. szabály: Eloszlás energiaszintek szerint
Az intuícióból azt hihetjük, hogy az elektronok először kitöltik azokat a pályákat, amelyek közelebb vannak a maghoz
De ez nem egészen igaz. Először kitöltik az alacsonyabb energiájú pályákat. Ezek többsége közelebb van a maghoz, de nem mindig
2. szabály: Megosztás távolság szerint
Amikor választhatnak ugyanazon energiapályák között, inkább a lehető legtávolabbra kerülnek
3. szabály: Eloszlás elektron centrifugálással
Hagyományos töltési módszer
Memóriasegédet használunk az 1. szabály (fent) betartásához:
 |
Csak kövesse a vonalat felülről lefelé. Töltse ki a pályát, és lépjen a következőre
Be kell tartania az egyes alhéjban lévő maximális elektronszámot:
- s: 2
- p: 6
- d: 10
- f: 14
Példa nemesgáz -konfigurációra:
- Ő: 1s2
- Ne: 1s2 2s2 2p6
- Ar: 1s2 2s2 2p6 3s2 3p6
- Kr: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
- Xe: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6
- Rn: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6
A módszer problémája a következő:
- Emlékeznie kell erre a memóriasegítőre
- Ellenőriznie kell az eddig használt elektronok számát
- Emlékeznie kell arra, hogy hány elektron fér el az egyes alhéjban (s, p, d, f)
- Sok időbe telik
A blokk módszer (The hack)
Itt elmagyarázok egy menő csapást:
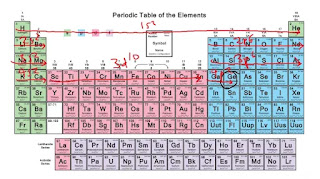
1. lépés: Címkézze a periódusos táblázatot blokkokban
2. lépés: Határozza meg a periódusos rendszerben a kívánt elemet, és karikázza be
3. lépés: Keresse meg a hidrogént kiindulópontként
4. lépés: Görgessen végig minden soron, balról jobbra és felülről lefelé, írja le az elektronkonfigurációt, amíg el nem éri az elemét
Ge: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
5. lépés: Ellenőrizze a munkát úgy, hogy hozzáadja az összes felső indexet, és megnézi, hogy összeadja -e az érdeklődő elem összes elektronjának számát. ez nem kötelező
2+2+6+2+6+2+10+2 = 32
Mitől jobb ez a módszer:
- Nem kell emlékeznie arra, hogy hány elektron fér el az egyes alhéjakban (s, p, d, f)
- Nem kell emlékeznie erre a memóriasegítőre
- Nem kell nyomon követnie az eddig használt elektronokat
- Sokkal kevesebb időt vesz igénybe
Rövidített elektronkonfiguráció
Amint fentebb látható, a standard eloszlás gyakran nagy elektronkonfigurációt eredményez
Ezekben az esetekben használhatunk rövidített konfigurációt (Condensed electron configuration). Nevezhetjük ezt hivatalos hackelésnek
Miért? Nos, észre fogja venni, hogy minden nehéz atomban mindig van egy teljes alhéj. Ez is ugyanaz a konfiguráció, mint az előző nemesgáz a periódusos rendszerben
Tehát az utolsó nemesgázt szögletes zárójelbe tesszük
Példa
A nátrium elektronkonfigurációja 1s² 2s² 2p⁶ 3s¹. Hogyan írjuk le rövidített formában?
1. lépés: Kiválasztjuk az utolsó nemesgázt. Ebben az esetben ez a neon elem
A neon konfiguráció 1s² 2s² 2p⁶, ezért lecseréljük[Xe] -re. :
[Ne]3s¹
A neont rövidíteni lehet[He] 2s² 2p⁶
Angol Verzió
Idézet
Amikor egy tényt vagy információt bele kell foglalnia egy feladatba vagy esszébe, akkor azt is meg kell adnia, hogy hol és hogyan találta meg ezt az információt (Elektronkonfiguráció).
Ez hitelességet kölcsönöz a dolgozatának, és néha szükség van rá a felsőoktatásban.
Az élet (és az idézet) megkönnyítése érdekében másolja be és illessze be az alábbi információkat a feladatába vagy esszébe:
Luz, Gelson. Elektronkonfiguráció (Teljes, Rövidített És Hűvös Hack). Anyagok Blog. Gelsonluz.com. nn hh eeee. URL.
Most cserélje ki a nn, hh és eeee dátumot, napot, hónapot és évet, amikor böngészett ezen az oldalon. Cserélje ki az oldal tényleges URL -jének URL -jét is. Ez az idézési formátum az MLA -n alapul.








Megjegyzések